Стригина Ирина Николаевна, учитель химии МАОУ СОШ №2 Режевской ГО
Скачать разработку урока >>> (.pdf 670 KB)
Скачать презентацию >>> (.pptx 2,13 МB)
Цели урока: на примере уксусной кислоты изучение химические свойства предельных одноосновных карбоновых кислот; показать сходство и отличие неорганических и органических кислот; развитие умения записывать химические реакции с участием органических веществ; формирование приёмов аккуратного и безопасного обращения с химическими веществами; развитие критического мышления, самостоятельности и способности к рефлексии;
Тип урока: урок изучения и первичного закрепления новых знаний.
Используемые технологии: технология критического мышления, ИКТ.
Приёмы обучения: лабораторный опыт, маркировка текста, работа в парах и группах, дидактические игры.
Оборудование и реактивы: для каждой группы — листы бумаги формата А1, маркеры; этиловый спирт, уксусная кислота, серная кислота, штатив, спиртовка, держатель, стакан с водой, штатив с пробирками.
ХОД УРОКА
| Содержание слайда | Деятельность
учителя |
Деятельность
обучающихся |
||
| I. ОРГАНИЗАЦИОННЫЙ МОМЕНТ | ||||
| Слайд №1 Тетрадь
Ручка Учебник (1 мин.) Дело |
Проверка готовности к
уроку |
Контролируют свою подготовку к уроку
|
||
| II. АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ. МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ | ||||
| Слайд №2 Что общего?
(2 мин.) |
Что объединяет помещённые на слайде изображения с точки зрения химии?
|
Находят сходство
(содержат карбоновые кислоты: муравьиная, лимонная, яблочная, уксусная) |
||
| Слайд №3-5 Зашифрованная фраза
ПFJOLYЗРYHSLALWHVТИXCEKE HKEACJЧLYИSDHGIALIEXDTG MCDOЯFKCSKУSJДВОИАWBSL ЛРОESTHXHИBLЯMU Аристотель (384–322 гг. до н. э.)
«Познание начинается с удивления» Аристотель (384–322 гг. до н. э.) (3 мин.) |
Задание:
расшифруйте фразу, автором, которой является Аристотель Согласны ли вы с данным утверждением?
!!! Проверим |
Отгадывают фразу, затем высказываются: согласны с данным утверждением или нет, аргументируют. | ||
| Слайд №6. Верите ли вы в то, что…
· в течение суток в организм человека образуется 400 г уксусной кислоты, что хватило бы для изготовления 8 л столового уксуса;
· отвинтить ржавую гайку поможет уксус;
· «оптимальное меню» — 18 л уксуса в сутки»?
(3 мин.) |
Проводится игра «Верите ли вы в то, что…»:
· Некоторые из карбоновых кислот получаются и расходуются в процессе обмена веществ в очень внушительных количествах. Например, в течение суток в организме человека образуется 400 г уксусной кислоты, что хватило бы для изготовления 8 л обычного уксуса. · Для отвинчивания ржавой гайки, например, на коллекторе автомашины, надо вечером положить на неё тряпку, смоченную в уксусной кислоте. Тогда утром отвинтить эту гайку будет значительно легче. · Однажды учёные ввели в компьютер сведения о калорийности различных пищевых продуктов и о сезонных колебаниях их стоимости, а компьютер должен был составить наиболее экономичное меню. После расчётов машина ответила: «Оптимальное меню — 18 л уксуса в сутки» |
|||
| Слайд №7
Можно ли прожить без знаний о КК? (1 мин.) |
· Может быть и
можно, но, чтобы считать себя образованными людьми, обязаны знать, что мы едим и пьем, с чем мы имеем дело в быту, что происходит в нашем организме. · Знать чем опасны эти вещества, с чем они могут прореагировать. |
Обучающиеся
высказывают свое мнение |
||
| (3 мин.)
Слайд 8-9
Кислоты реагируют
|
1. Впервые ли вывстречаетесь с кислотами
как класс соединений? 2. Можете ли вы предположить черты сходства? 3. Вспомните, пожалуйста, с чем реагировали неорганические кислоты? |
Класс кислот изучался
в курсе неорганической химии. Если есть сходство в стро ении, то оно есть и в хи- мических свойствах. Называют те классы соединений, с которыми вступают во взаимодейс- твие кислоты. |
||
| Так с чем же могут реагировать КК?
Постановка проблемы! !!! Почему нельзя одновременно употреблять в пищу кислые фрукты, соки, маринады и антибиотики пенициллинового ряда? |
Кислоты, содержащиеся в этих продуктах, могут
вступать в химическое взаимодействие с антибиотиками и нейтрализовать их действие формулирование темы урока. |
Формулируют тему | ||
| Слайд №10
Тема урока «Свойства карбоновых кислот» |
Записывают тему в
тетрадь |
|||
| III. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА | ||||
| !!! ХРОМОТЕРАПИЯ – лечение цветом (желтый – солнце, интуиция стимулирует нервную систему; синий – спокойствие, ум, снижает раздражительность; зеленый – эмоциональное равновесие, восстанавливает силы; оранжевый – стимулирует деятельность сердца.
|
||||
| Слайд №11
Памятка для обучающегося Внимательно читая текст, отмечай значками на полях (справа или слева), насколько новая и понятная для тебя информация: «+» — уже знал; «-» — новое; «!» — думал иначе; «?» — не понял, есть вопросы (5 мин.) Гимнастика для глаз |
Организую работу с
текстом. Текст выдаётся обучающимся. (См.Приложение1)голубой |
Читая текст, маркируют
его, руководствуясь памяткой. |
||
| Совместный анализ маркировки текста, выделяя новые знания и переходя к лабораторному эксперименту (реакция этерификации) | ||||
| Слайд №12
Лабораторный опыт «Взаимодействие карбоновых кислот со спиртами» Будьте аккуратны, соблюдайте правила ТБ!!! (3 мин.)
|
правила ТБ
(Оранжевый лист) |
Вспоминают правила ТБ | ||
| Слайд №13
Хронометр Время опыта – 5 мин.
|
Л/о
«Взаимодействие карбоновых кислот со спиртами», используя инструкцию (Приложение №2)
|
Изучают инструкцию, планируют опыт, выполняют его, записывают уравнение реакции | ||
| Слайд №14
Результаты опыта Реакция этерификации: Н2SO4,t0 СН3СООН + НОС2Н5 ↔ ↔ СН3СООС2Н5 + Н2О
(2 мин.) |
Запись уравнения на доске
· Как называется реакция взаимодействия кислоты со спиртом? · Каким запахом обладает полученный эфир? · Назовите сложный эфир. |
Записывают уравнения реакции, отвечают на вопросы. | ||
| IV. ПЕРВИЧНАЯ ПРОВЕРКА УСВОЕНИЯ ЗНАНИЙ. ПЕРВИЧНОЕ ЗАКРЕПЛЕНИЕ ЗНАНИЙ.
КОНТРОЛЬ И САМОПРОВЕРКА ЗНАНИЙ |
||||
| Слайд №15-21
Создаем кластер
(5 мин.) |
Кластер
«Химические свойства одноосновных, предельных карбоновых кислот (Приложение №3) желтый лист |
Создание кластера | ||
|
(5 мин.)
|
Презентация кластера
|
Презентуют свой
продукт |
||
| Слайд №22-23
Тестирование и самопроверка 1. б; 2. б; 3. г; 4. а (3 мин.) |
Рефлексия содержания учебного материала
(Приложение 4) Зеленый лист |
Выполняют тест и
проводят самопроверку |
||
| V. ПОДВЕДЕНИЕ ИТОГОВ УРОКА. РЕФЛЕКСИЯ | ||||
| Слайд №25
Заверши фразу: (1 мин.)
|
Итоговая рефлексия | Завершают предложения | ||
| VI. ДОМАШНЕЕ ЗАДАНИЕ | ||||
Приложение 1
Информация по теме «Химические свойства карбоновых кислот»
Внимательно читая текст, отмечай значками на полях (справа или слева), насколько новая и понятная для тебя информация:
«+» — уже знал; «−» — новое; «!» — думал иначе; «?» — не понял, есть вопросы
Многие химические свойства кислот объясняет электронно-структурная формула:
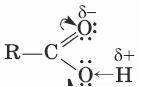
- Карбоновые кислоты — более сильные, чем спирты, поскольку атом водорода в
карбоксильной группе (СООН) обладает повышенной подвижностью благодаря влиянию группы (СО). В водном растворе карбоновые кислоты диссоциируют: RCOOH↔ RCOO— + Н+
Но из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты.
- Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот.
Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Ca →(RCOO)2Ca +Н2↑
2RCOOH + MgО → (RCOO)2 Mg +Н2О
RCOOH + NaOH → RCOONa + Н2О
2RCOOH + K2CO3 → 2RCOOK +СО2↑ + Н2О
- Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода:
RCH2− COOH + Br2 → RCHBr − COOH + HBr
- В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О
RСООН + O2 → CO2↑ + Н2О
5.Образование сложных эфиров. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
H2SO4, t0
RCOOH + НОR1 ↔ RCOOR1 + H2O
- а) В присутствии водоотнимающих средств (H2SO4(конц.)) муравьиная кислота отщепляет воду с выделением оксида углерода (II). б) Из-за наличия в молекуле НСООН альдегидного протона муравьиная кислота легко окисляется, дает реакцию «серебряного зеркала» и «медного зеркала».
Приложение 2
Инструкция для проведения лабораторного опыта
«Взаимодействие карбоновых кислот со спиртами»
Оборудование и реактивы: штатив с пробирками, спиртовка, держатель для пробирок, спички, уксусная кислота – СН3СООН, этиловый спирт – С2Н5ОН, серная кислота – Н2SO4 (катализатор), стакан с водой.
ХОД РАБОТЫ
Будьте аккуратны, соблюдайте правила ТБ!!!
- Налейте в пробирку уксусную кислоту (уровень жидкости приблизительно 1-1,5 см)
- Добавьте к уксусной кислоте этиловый спирт (уровень жидкости доведите до 2,5 -3 см).
- Отметьте, что происходит? Ощущается ли запах эфира?
- Если реакция не идет, добавьте в пробирку с реагентами катализатор (концентрированный раствор серной кислоты 4-5 капель) нагрейте пробирку с реагентами.
- Вылейте содержимое пробирки в стакан с водой, зафиксируйте запах полученного эфира (сладковато-резковатый, напоминающий запах ацетона).
- Составьте уравнение реакции взаимодействия уксусной кислоты и этилового спирта (реакция этерификации).
- Наведите порядок на рабочем месте.
Приложение 3
- СН3СООН + 2O2 → 2CO2↑ + 2Н2О
- НCOOH + KOH → НCOOK + Н2О
- 2СН3COOH + Na2CO3 → 2СН3COONa + СО2↑ + Н2О
NH3(р-p),t0
- НСООН + Ag2O → СО2↑ + Н2О + 2Ag↓
- 2НCOOH + ZnО → (СН3COO)2 Zn + Н2О
H2SO4, t0
- СН3 – CH2 − COOH + Cl2 → СН3 – CHCl − COOH + HCl
t0
- НСООН +2Cu(OH)2 → Cu2O↓ + CO2↑ + 3H2O
H2SO4, t0
- CH3COOH + НО-CH3 ↔ CH3COOCH3 + H2O
- 2CH3COOH + Mg → (CH3COO)2Mg + Н2↑
H2SO4(конц.)
- HCOOH → CO + H2O
Задание для группы №1
- I. Выберите (из данного перечня 1-10) уравнения химических реакций, характеризующие общие свойства карбоновых кислот, что их сближает со всеми кислотами (неорганическими и органическими)
- II. Составьте кластер (графическая форма организации информации)
Задание для группы №2
- I. Выберите (из данного перечня 1-10) уравнения химических реакций, характеризующие общие свойства карбоновых кислот, что их сближает только с органическими кислотами
- II. Составьте кластер (графическая форма организации информации)
Задание для группы №3
- I. Выберите (из данного перечня 1-10) уравнения химических реакций, характеризующие индивидуальные свойства муравьиной кислоты, что её отличает от других карбоновых кислот
- II. Составьте кластер (графическая форма организации информации)
Приложение 4
Тест
- При взаимодействии муравьиной кислоты с магнием образуются:
а) формиат магния и вода;
б) формиат магния и водород;
в) ацетат магния и вода;
г) ацетат магния и водород
- С уксусной кислотой не взаимодействует:
а) Na2CO3; б) HCl; в) Br2; г) КОН
- По углеводородному радикалу проходит реакция, уравнение которой:
а) CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
б) 2CH3COOH + Mg → (CH3COO)2Mg + H2↑
в) 2CH3COOH +CaO → (CH3COO)2Ca + H2O
г) CH3COOH + 3Cl2 → Cl3C−COOH + 3HCl
- 4. Уксусная кислота может реагировать с каждым из двух веществ:
а) гидроксидом меди (II) и метанолом;
б) метанолом и серебром;
в) серебром и гидроксидом меди (II)
г) магнием и метаном.
